Volumen 35, Nº 1 | 2017
Determinación y significancia pronóstica de la sialoproteína ósea como factor predictivo de metástasis óseas en cáncer de pulmón a células no pequeñas resecados quirúrgicamente - Determination and Prognosis significance of Bone sialoprotein (BSP) as a predictive factor for bone metastases in non-small cell lung cancer (NSCLC) removed surgically
Rodolfo Ávila, Martha V Zovak, María Kurpis, Vanesa Palla, Ana Lisa Basquiera, Juan José García, Emilio Palazzo, Mario EF Bustos, Carlos Brocca
Palabras clave: sialoproteína ósea, metástasis óseas, cáncer de pulmón a células no pequeñas
Keywords: bone sialoprotein, bone metastases, non-small cell lung cancer.
INTRODUCCIÓN
La presencia de metástasis óseas (MO) es frecuente en el carcinoma de pulmón a células no pequeñas (CPCNP), estas pueden presentarse al diagnóstico o desarrollarse durante la progresión tumoral y comprenden cerca del 35 % de las MO reportadas (1).
En el proceso de diseminación tumoral sitio específica, la interacción que se produce entre la célula invasora y el órgano huésped es crítica (2). Varios estudios han tratado de poner en evidencia los mecanismos involucrados en la invasión tumoral y la formación de metástasis óseas específicamente, se sabe que la interacción entre algunas proteínas expresadas en la membrana celular y la matriz extracelular representan un importante paso (3, 4).
Si bien se analizaron muchos marcadores involucrados en la colonización y desarrollo de metástasis esqueléticas con técnica de inmunohistoquímica como la catepsina K, osteopontin (OPN), matrix metalloproteinase-2 (MMP-2) y el inhibidor tisular de metalloproteinasa-1 (TIMP-1), entre otros, el único que demostró una relación significativa con la diseminación ósea e independientemente con una menor supervivencia global en cáncer de mama, próstata y más recientemente cáncer de pulmón fue la sialoproteína ósea (SPO) (5-9).
La SPO es una proteína de la matriz ósea, producida por los osteoblastos y osteoclastos, que tiene función en el metabolismo óseo normal, en la mineralización de la matriz extracelular y en el remodelado óseo (10,11), esta se expresaría en algunos tumores osteotróficos jugando un rol importante en el desarrollo de MO (5,6,12-14). Por lo tanto, existiría una subpoblación de CPCNP con predisposición al desarrollo de metástasis óseas que expresaría un patrón inmunohistoquímico diferente al de aquellos que no metastatizan en hueso. Por otro lado, se han publicado diversos estudios que demostraron que el uso de bisfofonatos podría disminuir y retrasar la aparición de eventos óseos en algunos tumores sólidos (15-18).
Es por esto que creemos de importancia la identificaciónde este subgrupo de pacientes con diagnóstico de CPCNP y sobreexpresión de SPO, que presentaría mayor predisposición al desarrollo de metástasis óseas y menor supervivencia, ya que podría beneficiarse de una intervención terapéutica preventiva con el propósito de bloquear o demorar el desarrollo de MO.
En este estudio retrospectivo nuestro propósito fue correlacionar la relación entre la expresión de SPO y la diseminación ósea, como así también su impacto en la supervivencia en pacientes con CPCNP resecados quirúrgicamente.
MATERIALES Y MÉTODOS:
Se recolectaron de manera retrospectiva, en el período comprendido entre enero del año 2000 a diciembre del año 2009, los datos de pacientes con diagnóstico de CPCNP.
De todos ellos, fueron incluidos en este estudio aquellos con diagnóstico de CPCNP histológicamente confirmado, en estadios IA a IIIB, que hubieran sido resecados quirúrgicamente en forma completa en el Hospital Privado Universitario de Córdoba y cuyo seguimiento haya estado a cargo del equipo de médicos de dicha institución.
En los 56 casos que cumplieron los requisitos para ingresar en nuestro estudio, se registraron los datos provenientes de las historias clínicas referentes a edad, sexo, antecedentes de tabaquismo, estadio, tipo histológico y evolución. En 9 casos no fue posible realizar la marcación inmunohistoquímica para SPO debido a las siguientes razones: un caso recibió quimioterapia neoadyuvante y no se encontró tumor viable en los tacos de biopsia, 2 tacos no pudieron ser recuperados y en los 6 restantes el material guardado se encontraba no apto para la marcación. En total fueron incluidos para el análisis 47 casos.
TÉCNICA INMUNOHISTOQUIMICA Y SCORE
Los 47 tacos de muestras de tejidos fueron fijados en formol al 10% y embebidos en parafina. Se les realizaron cortes de 5 um y se procedió a la desparafinización y rehidratación de los mismos. Se bloqueó la actividad de la peroxidasa endógena con una solución de peróxido de hidrógeno al 3% en metanol durante 30 min. Se incubaron con el anticuerpo primario contra sialoproteina ósea (BSP) (policlonal de conejo, MILIPORE,) por 1 hora 30 minutos en una dilución 1/1000, se enjuagaron con buffer PBS. Se incubaron con anticuerpo secundario por 15 min. y luego con el reactivo terciario por 15 min. (LSAB+, DAKO®) lavando entre cada paso con buffer PBS. Por último se reveló la reacción inmunohistoquímica con diaminobencidina (DAB+, DAKO®).
Los cortes se contracolorearon con hematoxilina, se deshidrataron y se montaron para su visualización. El proceso de la inmunoshistoquímica fue realizada por una técnica de laboratorio (VP) y todos los cortes fueron revisados por la misma patóloga, que no conocía la evolución de los pacientes. Como control positivo de la técnica se utilizaron cortes de una metástasis ósea de un tumor de mama como lo indica el inserto del anticuerpo primario.
Para informar los resultados se los clasificó según la distribución de la marcación en homogénea/heterogénea y según la intensidad en cruces. Los casos se clasificaron como positivos (++ y +++) o negativos (0 y +) de acuerdo a lo publicado por Waltregny y cols (5,6). Además se analizaron en forma separada los casos con +++ para SPO.
ANÁLISIS ESTADÍSTICO
La expresión de la SPO entre paciente con y sin metástasis óseas se comparó por chi-cuadrado. La supervivencia libre de metástasis óseas y la supervivencia global se calcularon por Kaplan-Meier. La diferencia en supervivencia se calculó por logrank test.
RESULTADOS
La edad media de los 47 pacientes en los que se realizó la marcación inmunohistoquímica para SPO fue 60,6 años (rango de 45-85), el 72,4% fueron varones, y el 93,6% presentó antecedente de tabaquismo. Los estadios de presentación más frecuente fueron IA y IB en el 57,4% de los pacientes. La histología predominante fue adenocarcinoma, seguido por carcinoma epidermoide. En la Tabla 1 se pueden ver las principales características clínicas e histológicas de los 47 pacientes analizados.
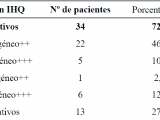
De los 47 pacientes analizados, 34 (72,4%) presentaron tinción positiva para SPO (Grupo A). En 13 (27,6%) la tinción fue considerada negativa (Grupo B).
En la Tabla 2 se puede observar el resultado de los patrones de tinción para sialoproteína ósea (SPO).
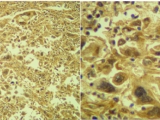
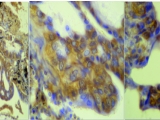
En la Figura 1 se puede ver la expresión de SPO con patrón homogéneo +++, en un carcinoma escamoso. En la figura 2 se puede ver la expresión de SPO con patrón heterogéneo +++, en un adenocarcinoma.
MENOR A MAYOR AUMENTO
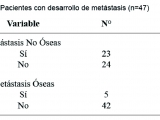
La mediana de seguimiento de los pacientes fue de 20,5 meses. De los 47 pacientes en los que se pudo obtener la marcación para SPO, veintitrés presentaron desarrollo de metástasis en diferentes sitios, pero sólo cinco de ellos progresó a nivel óseo. Veinticuatro pacientes no desarrollaron metástasis.
En la Tabla 3 se puede observar el número de pacientes con desarrollo de metástasis óseas y los que no presentaron metástasis. De los 5 pacientes que desarrollaron metástasis óseas, 3 casos fueron positivos para SPO y 2 casos negativos (p=0,54).
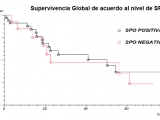
La supervivencia global para todo el grupo (mediana) fue 40,9 meses (IC 95% 6,543644 to 75,256356); la supervivencia global de acuerdo a la positividad para SPO fue para el grupo A, SPO positiva 50,2 meses (IC 95% 21,7 a 78,8) y para el grupo B, SPO negativa 22,63 meses (IC 95% 19,13 a 72,83); p 0,6519 (Fig. 3)
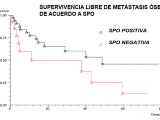
La supervivencia libre de metástasis óseas fue en el grupo A SPO positiva de 48,7 meses (IC 95% 17,97 a 78,77; en el grupo B SPO negativa de 11,03 meses (IC 95% 4,3 a 42,93). P= 0, 5257 (Fig. 4).
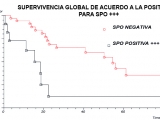
Además se analizaron los casos con positividad +++ (heterogénea y homogénea) para supervivencia global y sobrevida libre de metástasis. No hubo diferencias en la supervivencia para metástasis óseas pero encontramos diferencia para supervivencia global con peor supervivencia para los pacientes SPO positiva (Fig. 5) mediana 15,43 meses (IC 95% 10,7 a 20,11meses) versus 54,46 meses (IC 95% 46,96 a 61,97 meses); p=0,0086.
DISCUSIÓN
El crecimiento de la evidencia actual en relación al rol pronóstico que jugaría la expresión de SPO en el desarrollo de MO en diferentes tumores sólidos, entre ellos el CPCNP, podría tener un rol importante en el manejo futuro de estos pacientes, ya que identificar un grupo con alto riesgo para el desarrollo de metástasis óseas podría ayudar a mejorar la modalidad de tratamiento con el uso de medicamentos útiles en esta situación como los bifosfonatos.
Estudios con estos medicamentos han demostrado su eficacia en reducir y retrasar los eventos óseos en pacientes con MO (17) y también retrasar la diseminación ósea en pacientes con tumores sólidos recurrentes o metastásicos (15,18), lo que sugeriría su aplicación como preventivo a la formación de MO.
Dos estudios recientes, uno de origen italiano publicado por Papotti y cols. (8) y otro de origen chino publicado por Li Zhang y cols. (9), han podido demostrar que la sobreexpresión de SPO en pacientes con diagnóstico de CPCNP resecados quirúrgicamente se correlaciona con una mayor predisposición al desarrollo de MO y con un peor pronóstico que aquellos que no la sobreexpresan. Ambos estudios utilizaron un método similar para la marcación inmunohistoquímica de SPO.
En su trabajo, Papotti y cols. presentaron sobreexpresión de SPO el 40% de los pacientes y la positividad fue considerada independiente del porcentaje de células tumorales marcadas; solo las muestras que no presentaron ningún tipo de marcación (0%) fueron interpretadas negativas. En este trabajo la positividad fue similar en los distintos tipos histológicos (adenocarcinoma vs no adenocarcinoma) y no se realizó correlación con otras variables clínico patológicas.
En el trabajo de Li Zhang y cols. la sobreexpresión de SPO estuvo presente en el 70% de los pacientes y se consideraron positivos aquellos pacientes que tuvieron más del 50% de células tumorales marcadas. En el estudio se vio que aquellos con adenocarcinoma presentaron mayor porcentaje de positividad para SPO que los no adenocarcinoma (39,1% vs 6,2%), lo que llamo la atención ya que el adenocarcinoma es más propenso al desarrollo de metástasis a distancia y que el grupo de pacientes con estadíos mas avanzados presentaron menor supervivencia libre de metástasis.
Ambos estudios han podido demostrar la fuerte relación entre la positividad de SPO con el desarrollo de metástasis óseas, el peor pronóstico y la menor supervivencia libre de progresión ósea. Estos datos sugieren que la SPO podría ser utilizada como en marcador predictivo de alto riesgo en pacientes con CPCNP al momento de la cirugía.
En nuestro trabajo intentamos reproducir estos resultados para evaluar la posibilidad de utilizar este marcador como factor pronóstico en este grupo de pacientes y obtuvimos una sobreexpresión en el 79,2 % de las muestras, consideramos negativos aquellos que presentaron intensidad de marcación en + y como positivos los que presentaron ++ y +++ cruces. No encontramos relación entre el tipo histológico y la expresión de SPO. No obtuvimos diferencias estadísticamente significativas en supervivencia libre de metástasis ni en supervivencia global entre los SPO+ y SPO-, pero si pudimos ver que aquellos que tuvieron una fuerte marcación (+++) presentaron diferencia en supervivencia global. Sin embargo en nuestra serie solo 5 pacientes presentaron desarrollo de metástasis óseas, lo que creemos podría explicar esta falta de significancia estadística en nuestros resultados.
CONCLUSIÓN
En nuestro grupo de pacientes, la expresión de SPO en el tumor primario no fue predictor de metástasis óseas. Sin embargo, la baja incidencia de metástasis óseas en esta serie podría explicar la diferencia con los hallazgos de otros estudios. Una alta intensidad de SPO podría asociarse a menor supervivencia global.
Bibliografía
1. Coleman RE. Skeletal complications of malignancy. Cancer 1997; 80:1588-94.2. Horak CE,Steeg PS, Metastasis gets site specific. Cancer Cell 2005;8: 93-5.
3. Cho NH, Hong KP, Hong SH, Kangs S, Chung KY, Cho SH. MMP expression profiling in recurred stage IB lung cancer. Oncogene 2004; 23: 845-51.
4. Brubaker KD, Vassella RI, True LD, Thomas R, Corey E. Cathepsin K mRNA and protein expression in prostate cancer progression. J Bone Miner Res 2003; 18: 222-30.
5. Waltregny D, Bellahcène A, Van Riet I, Fisher LW, Young M, Fernandez P, et al.
Prognostic value of bone sialoprotein expression in clinically localized human
prostate cancer. J Natl Cancer Inst 1998;90:1000–8.
6. Waltregny D, Bellahcène A, de Leval X, Florkin B, Weidle U, Castronovo V. Increased expression of bone sialoprotein in bone metastases compared with visceral metastases in human breast and prostate cancers. J Bone Miner Res. 2000;15:834–43.
7. Bellahcène A, Castronovo V, Ogbureke KUE, Fisher LW, Fedarko NS. Small integrin-binding ligand N-linked glycoproteins (SIBLINGs): multifunctional proteins in cancer. Nat Rev Cancer 2008;8(3):212–26.
8. Papotti M, Kalebic T, VolanteM, Chiusa L, Bacillo E, Cappia S, et al. Bone sialoprotein is predictive of bone metastasis in resectable non-small-cell lung cancer: a retrospective case–control study. J Clin Oncol 2007;24:4818–24.
9. Li Zhang, Xue Hou. Predictive significance of bone sialoprotein and osteopontin for bone metastases in resected Chinese non-small-cell lung cancer patients: A large cohort retrospective study. Lung Cancer. 2010 Jan;67(1):114-119.
10. Ganss B, Kim RH, Sodek J. Bone sialoprotein. Crit Rev Oral Biol Med 1999;10: 79-98.
11. Hunter G, Goldberg H. Modulation of crystal formation by bone phosphoproteins: role of glutamic acid-rich sequences in the nucleation of hydroxyapatite by bone sialoprotein. J Biol Chem 1994;302:175–9.
12. Bellahcène A, Kroll M, Liebens F, Castronovo V. Bone sialoprotein expression in primary human breast cancer is associated with bone metastases development. J Bone Miner Res 1996;11:665–70
13. Bellahcène A, Maloujahmoum N, Fisher LW. Expression of bone sialoprotein in human lung cancer. Calcif Tissue Int 1997;61:183–8.
14. Diel IJ, Solomayer EF, Seibel MJ, Pfeilschifter J, Maisenbacher H, Gollan C, et al. Serum bone sialoprotein in patients with primary breast cancer is a prognostic marker for subsequent bone metastasis. Clin Cancer Res 1999;5:3914–9.
15. Michaelson MD, Smith MR. Bisphosphonates for treatment and prevention of bone metastases. J Clin Oncol 2005;23:8219–24.
16. Smith MR, Eastham J, Gleason DM, Shasha D, Tchekmedyian S, Zinner N. Randomized controlled trial of zoledronic acid to prevent bone loss in men receiving androgen deprivation therapy for nonmetastatic prostate cancer. J Urol 2003;169:2008–12.
17. Rosen LS, Gordon D, Tchekmedyian S, Yanagihara R, Hirsh V, Krzakowski M, et al. Long-term efficacy and safety of zoledronic acid in the treatment of skeletal metastases in patients with non small cell lung carcinoma and other solid tumors: a randomized, phase III, double-blind, placebo-controlled trial. Cancer. 2004;100:2613–21.
18. Mystakidou K, Katsouda E, Parpa E, Kelekis A, Galanos A, Vlahos L. Randomized, open label, prospective study on the effect of zoledronic acid on the prevention of bone metastases in patients with recurrent solid tumors that did not present with bone metastases at baseline. Med Oncol 2005;22:195–201.
19. Santini D, Vincenzi B, Dicuonzo G, Scarpa S, Baldi A. Zoledronic acid induces significant and long-lasting modifications of circulating angiogenic factors in cancer patients. Clin Cancer Res 2003;9:2893–7.